Уже доступны результаты дополнительного анализа прямого сравнительного исследования применения акалабрутиниба и ибрутиниба у пациентов с рецидивами ХЛЛ — ELEVATE-RR.
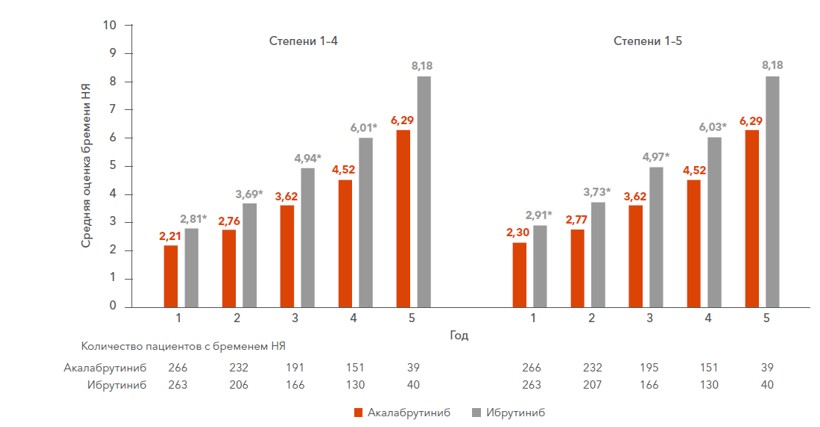
Результаты дополнительного анализа 2023 года в очередной раз подтвердили более благоприятный профиль безопасности акалабрутиниба по сравнению с ибрутинибом1-2.
НЯ на акалабрутинибе на протяжении каждого года 5-летнего наблюдения возникали реже и бремя от них было значительно ниже, чем при применении ибрутиниба, и как следствие, меньше пациентов, принимающих акалабрутиниб, прекратили терапию по причине НЯ1-2.
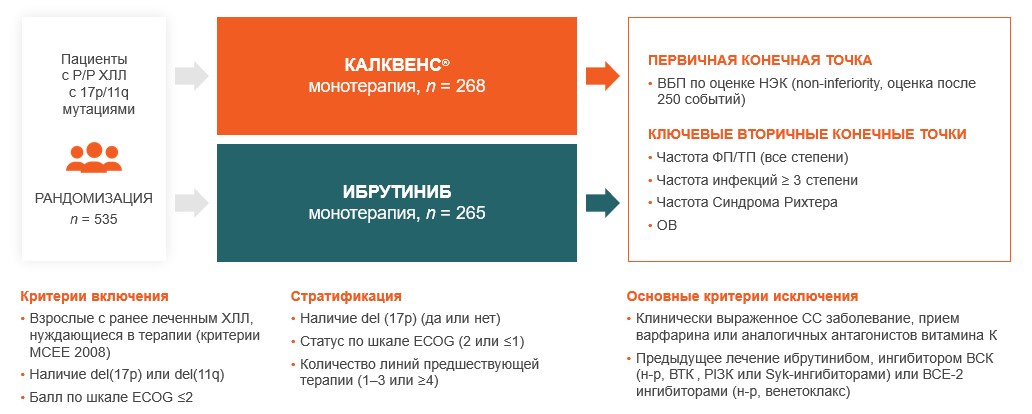
Дизайн исследования2
В рандомизированное открытое многоцентровое исследование ELEVATE-RR было включено 533 пациента с хроническим лимфоцитарным лейкозом c высоким цитогенетическим риском (с наличием делеции 17p или 11q), получивших одну или несколько предшествующих линий терапии. Они были рандомизированы в соотношении 1:1. Пациенты первой группы получали акалабрутиниб (100 мг перорально два раза в день), а пациенты второй группы ибрутиниб (420 мг перорально один раз в день). Лечение продолжали до прогрессирования заболевания или неприемлемой токсичности 1-2.
Первичной конечной точкой исследования была выживаемость без прогрессирования, которая оценивалась независимым комитетом. Вторичные конечные точки включали частоту развития фибрилляции предсердий, частоту развития инфекций ≥3 степени, возникших в связи с лечением, частоту трансформации Рихтера и общую выживаемость1-2.
Как вы уже знаете, Калквенс® достиг первичной конечной точки по выживаемости без прогрессирования — медиана ВБП составила 38,4 месяца для акалабрутиниба и ибрутиниба в группах пациентов с РР ХЛЛ при медиане наблюдения 40,9 мес (по оценке независимого комитета) 1-2. Медиана общей выживаемости не была достигнута ни в одной группе 1-2.
Результаты дополнительного анализа 2023 года в очередной раз подтвердили более благоприятный профиль безопасности акалабрутиниба по сравнению с ибрутинибом: Калквенс® продемонстрировал снижение риска возникновения фибрилляций и трепетания предсердий на 41% по сравнению с ибрутинибом. Кроме того, акалабрутиниб ассоциировался с меньшей частотой возникновения артралгии (15,8% против 22,8%) и диареи (34,6% против 46%). Также было меньше случаев инфекций и пневмонита при приеме акалабрутиниба1-2.
Обе группы лечения имели одинаковую частоту НЯ 3 степени и выше, включая трансформацию Рихтера1-2.
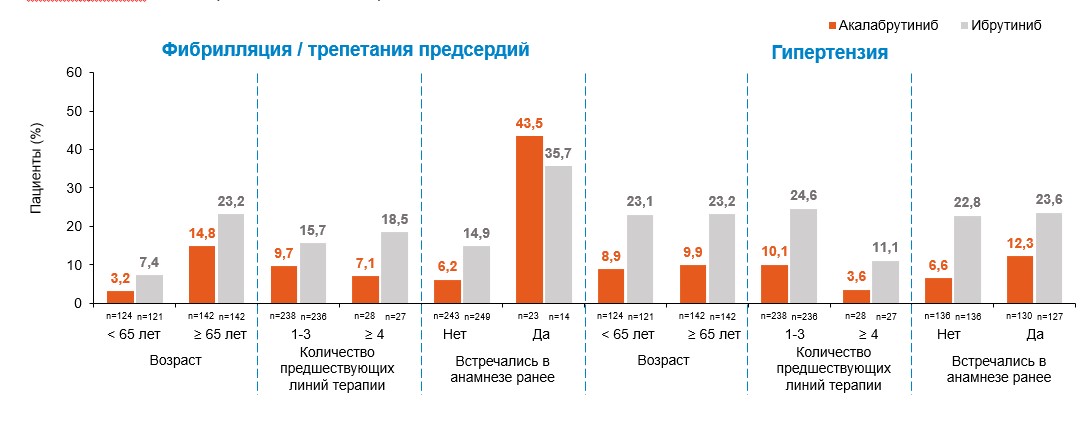
Согласно дополнительному анализу исследования ELEVATE-RR артериальная гипертензия возникала реже в группе акалабрутиниба независимо от возраста, количества предшествующих линий терапии, наличия гипертензии ранее в анамнезе у пациентов.
Фибрилляция / трепетания предсердий возникали реже в группе акалабрутиниба независимо от возраста, количества предшествующих линий терапии и в случае, если у пациентов не было ранее в анамнезе ФП/ТП. Если ФП/ТП встречались в анамнезе ранее показатель был выше в группе акалабрутиниба, однако абсолютная разница в пациентах составила 9 человек (23 на акалабрутинибе vs 14 на ибрутинибе) из 529 пациентов, принимавших участие в исследовании1.
Из-за малой выборки был проведен дополнительный Cox анализ, который доказал отсутствие значимой разницы в частоте фибрилляции/трепетания предсердий во время исследования между группами лечения.
При этом важно помнить, что время до момента первого возникновения ФП/ТП в группе акалабрутиниба было в 2 раза больше, чем в группе ибрутиниба1-2.
При выборе лекарственной терапии следует принимать во внимание и фармакоэкономический аспект.
Годовой курс терапии ХЛЛ препаратом Калквенс® стоит на 16% дешевле годового курса ибрутиниба3.
Таким образом, представленные результаты исследования ELEVATE-RR в сочетании с фармакоэкономическими преимуществами препарата Калквенс® делают обоснованным его выбор для терапии пациентов с рецидивами ХЛЛ.
ХЛЛ — хронический лимфолейкоз, ФП/ТП — фибрилляция / трепетания предсердий, НЯ — нежелательное явление, ВБП — выживаемость без прогрессирования, НЭК — независимый экспертный комитет, ОВ — общая выживаемость
Источники:
- Seymour, John F., et al. «Detailed safety profile of acalabrutinib vs ibrutinib in previously treated chronic lymphocytic leukemia in the ELEVATE-RR trial.» Blood 142.8 (2023): 687-699.
- Byrd JC et al., Acalabrutinib Versus Ibrutinib in Previously Treated Chronic Lymphocytic Leukemia: Results of the First Randomized Phase III Trial. J Clin Oncol. 2021 Nov 1;39(31):3441-3452. doi: 10.1200/JCO.21.01210. Epub 2021 Jul 26. PMID: 34310172; PMCID: PMC8547923.
- Недогода С.В., Саласюк А.С., Барыкина И.Н., Лутова В.О., Попова Е.А. Клинико-экономическое исследование применения акалабрутиниба у пациентов с хроническим лимфолейкозом. Современная Онкология. 2021;23(4):612–620.
КАЛКВЕНС ® краткая общая характеристика лекарственного препарата
Pегистрационный номер: ЛП-№(002855)-(РГ-RU) от 24.07.2023 Наименование лекарственного препарата: Калквенс®, 100 мг, капсулы
Качественный и количественный состав: каждая капсула содержит 100 мг акалабрутиниба. Лекарственная форма: капсулы
Показания к применению: Хронический лимфоцитарный лейкоз (ХЛЛ)/мелкоклеточная лимфоцитарная лимфома (МЛЛ) у взрослых пациентов.
Мантийноклеточная лимфома (МКЛ) у взрослых пациентов, которые получили, по крайней мере, одну линию терапии. Режим дозирования и способ применения: Терапию препаратом Калквенс® следует начинать и проводить под контролем врача, имеющего опыт проведения противоопухолевой лекарственной терапии. Хронический лимфоцитарный лейкоз (ХЛЛ)/мелкоклеточная лимфоцитарная лимфома (МЛЛ): 100 мг (1 капсула) 2 раза в сутки в виде монотерапии или в комбинации с обинутузумабом. Мантийноклеточная лимфома: 100 мг (1 капсула) 2 раза в сутки. Интервал между приемом доз должен составлять примерно 12 часов. Рекомендуется продолжать терапию до прогрессирования заболевания или развития неприемлемой токсичности.
Пропуск приема дозы препарата: Если пациент пропустил прием препарата Калквенс® более чем на 3 часа, следующую дозу препарата следует принять в следующее обычное запланированное время. Не следует принимать дополнительную капсулу препарата для компенсации пропущенной дозы.
Коррекция дозы: Следует временно приостановить терапию препаратом Калквенс® для устранения негематологических нежелательных реакций 3 степени тяжести и выше, тромбоцитопении 3 степени тяжести со значимым кровотечением, тромбоцитопении 4 степени тяжести или нейтропении 4 степени тяжести длительностью более 7 дней. После разрешения нежелательной реакции до 1 степени тяжести или до исходного уровня следует возобновить терапию (рекомендации по коррекции дозы препарата Калквенс® при нежелательных реакциях, а также, применение с ингибиторами или индукторами изоферментов цитохрома CYP3A и препаратами, снижающими кислотность желудочного сока см. в полном варианте общей характеристики лекарственного препарата).
Дети и подростки: Безопасность и эффективность применения препарата Калквенс® у детей и подростков в возрасте младше 18 лет не установлены. Данные отсутствуют. Способ применения: Капсулы препарата Калквенс® следует проглатывать целиком, запивая водой, приблизительно в одно и то же время суток, независимо от приема пищи. Капсулу не следует разжевывать, растворять или открывать. Противопоказания: Гиперчувствительность к акалабрутинибу или к любому из вспомогательных веществ, перечисленных в полном варианте общей характеристики лекарственного препарата. Фертильность, беременность и лактация: Препарат Калквенс® не следует применять во время беременности, и женщинам с сохраненной репродуктивной функцией следует избегать наступления беременности во время терапии препаратом Калквенс®. Нет данных о том, что акалабрутиниб выделяется с грудным молоком. Нет данных о влиянии акалабрутиниба на младенцев, получающих грудное вскармливание, или на выработку грудного молока. Нет данных о влиянии препарата Калквенс® на фертильность у людей. Нежелательные реакции: Резюме профиля безопасности Общий профиль безопасности акалабрутиниба основан на данных 1040 пациентов с онкогематологическими заболеваниями, получавших монотерапию акалабрутинибом. Наиболее частыми нежелательными лекарственными реакциями (≥20%) различной степени тяжести, отмеченными у пациентов, получавших акалабрутиниб, были инфекция, головная боль, диарея, кровоподтеки, боль в мышцах и костях, тошнота, утомляемость и сыпь. Наиболее частыми (≥5%) нежелательными лекарственными реакциями ≥3 степени тяжести были инфекция (17.6%), нейтропения (14.2%) и анемия (7.8%). Из-за развития нежелательных явлений у 4.2% пациентов доза препарата была снижена, у 9.3% пациентов терапия была прекращена. Медиана интенсивности дозы составила 98.7%. Передозировка: Симптомы передозировки препарата Калквенс® не установлены, специфическое лечение отсутствует. В случае передозировки препарата пациенты должны находиться под пристальным медицинским наблюдением для выявления возможных признаков и симптомов нежелательных реакций и, при необходимости, получать симптоматическое лечение.
Фармакотерапевтическая группа: противоопухолевые средства; ингибиторы протеинкиназ; ингибиторы тирозинкиназы Брутона (ВТК). Код АТХ: L01EL02
Срок годности: 3 года Особые меры предосторожности при хранении: при температуре не выше 30 ºС.
Имеются противопоказания. Перед назначением препарата ознакомьтесь, пожалуйста, с полным вариантом общей характеристики лекарственного препарата.
Дальнейшая информация предоставляется по требованию:
ООО АстраЗенека Фармасьютикалз
Российская Федерация, 123112, Москва, 1-й Красногвардейский проезд, д. 21, стр. 1, этаж 30, комнаты 13 и 14
Тел.: +7 (495) 799 56 99, факс: +7 (495) 799 56 98
Материал предназначен для специалистов здравоохранения. Имеются противопоказания. Перед назначением ознакомьтесь, пожалуйста, с полной инструкцией по применению.
RU-19656 Дата одобрения: 27/12/2023 Дата истечения: 27/12/2025

