Рецевмотм (селперкатиниб) — селективный RET ингибитор, для лечения распространённых опухолей с изменениями в гене RET (с мутацией RET при медуллярном раке щитовидной железы и со слиянием RET при раке щитовидной железы)1
Данные исследования 1/2 фазы LIBRETTO-001 (крупнейшего клинического исследования у пациентов с различным распространенными солидными опухолями) легли в основу регистрации препарата в раке щитовидной железы с изменениями в гене RET2,3,4
В июне 2023 г. на территории Российской Федерации был зарегистрирован лекарственный препарат Рецевмо™ (МНН — Селперкатиниб), Регистрационное удостоверение ЛП№(002482) — (РГ-RU)1
|
В соответствии с инструкцией по медицинскому применению, препарат показан к применению у взрослых и детей в возрасте 12 лет и старше с:1
|
|
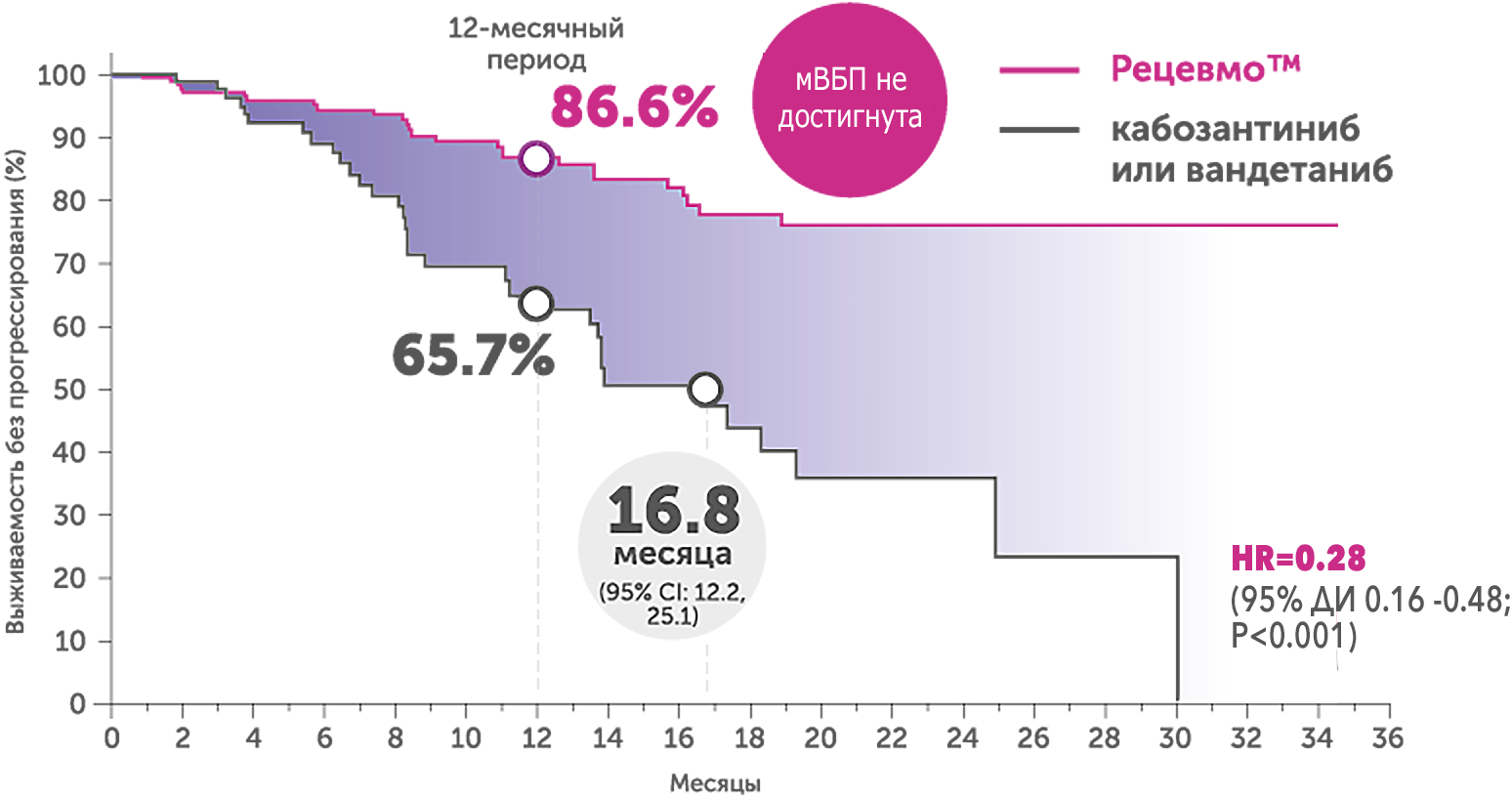
Терапия селперкатинибом продемонстрировала статистически достоверную эффективность и безопасность по сравнению с кабозантинибом и вандетанибом при МРЩЖ в исследовании III фазы LIBRETTO 531:5 |
Выживаемость без прогрессирования
В группе селперкатиниба мВБП не была достигнута по сравнению с 16.76 мес. в группе кабозантиниба/вандетаниба (ОР 0.28 (95% ДИ 0.16 -0.48; P<0.001));
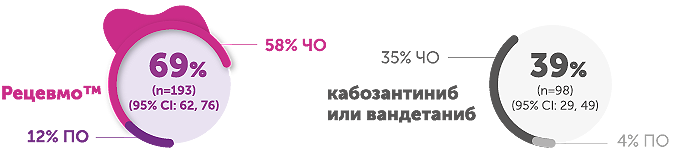
Частота объективного ответа
Ответ на терапию в группе селперкатиниба составил 69,4% по сравнению с 38,8% в группе кабозантиниба/вандетаниба
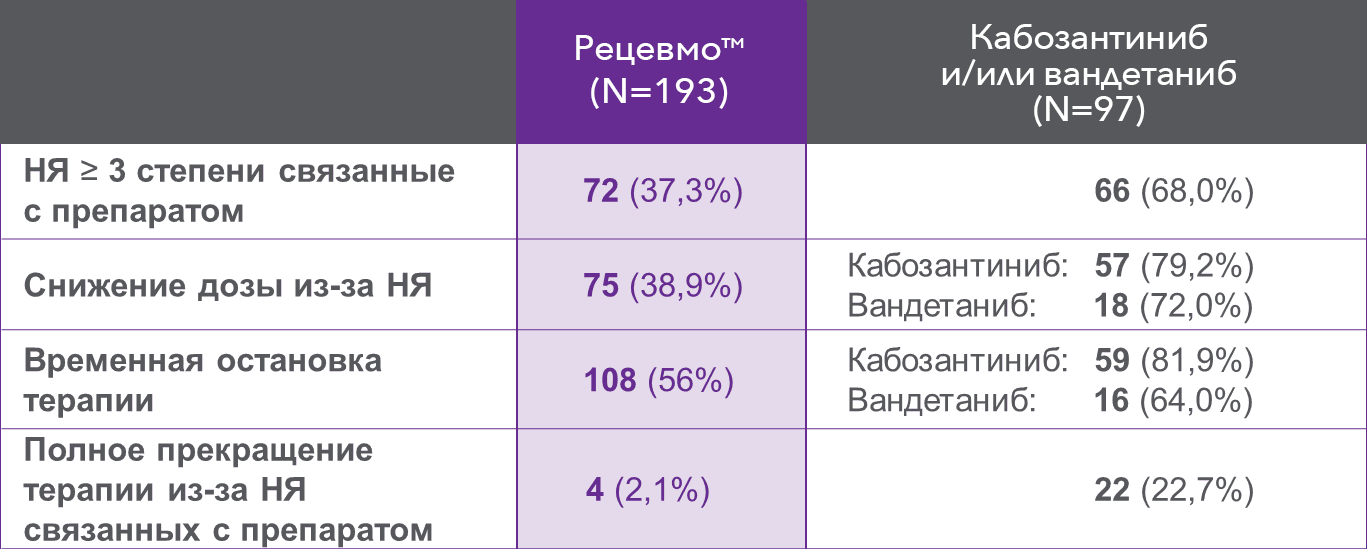
Частота отмены терапии из-за НЯ в группе селперкатиниба составила 2,1% против 22,7% в контрольной группе
|
Применение лекарственного препарата Рецевмо™ (МНН — Селперкатиниб) в реальной клинической практике в качестве нового стандарта терапии RET-позитивного рака щитовидной железы, включенного в национальные клинические рекомендации, может помочь в увеличении продолжительности жизни пациентов в сочетании с низкой токсичностью лечения и сохранением качества жизни.6,7 На сегодняшний день осуществлен ввоз на территорию Российской Федерации и ввод в гражданский оборот первой партии лекарственного препарата Рецевмотм, капсулы 40 мг. |
Ген RET (rearrangement during transfection) локализуется на длинном плече 10-й хромосомы, является прото-онкогеном, кодирует рецепторную тирозин-киназу RET.8
мБВП — медиана выживаемости без прогрессирования
ЧОО — частота объективного ответа
ПО — полный ответ
ЧО — частичный ответ
НЯ — нежелательное явление
- Инструкция по медицинскому применению препарата Рецевмотм ЛП-№(002482) — (РГ-RU) от 10.06.2024.
- Drilon A,et al Lung Cancer. N Engl J Med. 2020 Aug 27;383(9):813-824.
- Wirth L, et al. N Engl J Med 2020;383(9):825–835.
- FDA label RETEVMO, дата обращения от 10.10.2024
- Hadoux J,et al N Engl J Med 2023;389(20):1851-61
- Клинические рекомендации МЗ РФ «Медуллярный рак щитовидной железы 2024», дата обращения 10.10.2024
- Клинические рекомендации МЗ РФ «Дифференцированный рак щитовидной железы 2024», дата обращения 10.10.2024
- Knowles PP, et al J Biol Chem. 2006 Nov3;281(44):33577-87.
Полная информация представлена в инструкции по медицинскому применению лекарственного препарата Рецевмотм ЛП-№(002482)-(РГ-RU) от 10.06.2024.
Данный материал разработан компанией Swixx BioPharma.
Компания Eli Lilly не несёт никакой ответственности в отношении содержания и использования любых таких материалов.
Материал предназначен только для специалистов здравоохранения.
PM-RU-2024-9-5303 October 2024

